|
Aufbau des VDA-Etiketts (-Warenanhängers) mit Strichcode nach VDA 4902 Version 4 mit kostenlosem Download einer Excel-Vorlage für die Etikettenerstellung |
|
|
|
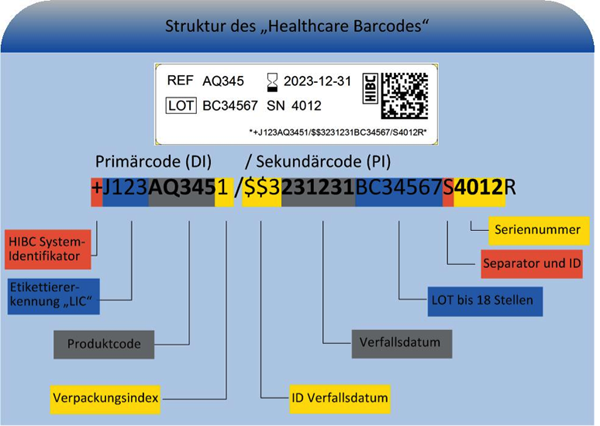
Der VDA-Warenanhänger ist ein Standard für die Zulieferer der Automobilindustrie. Alle Wareneingänge werden anhand des Anhängers (oder Klebeetiketts) erfasst (reale Größe A5 quer). Auf diesem VDA-Etikett (teilweise auch als Odette geläufig) ist fast alles enthalten, was für einen Wareneingang mit Strichcodes nützlich sein kann. Nachdem das wichtige Feld Bestellnummer des Kunden bei der Norm nicht enthalten ist, wird manchmal das Feld 15 Packstücknummer (S) hierfür genutzt. Anhand der Nummer öffnet der Kunde bei einem Wareneingang “seine” Bestellung und gleicht die eingegangenen Positionen mit den bestellten ab. Als Barcode wird hier Code 39 verwendet. Bei den Strichcodes wird hier ein Identifier genutzt und vorangestellt. Beispiel: Im Feld 9 Füllmenge (Q) wird das Q mit im Code verschlüsselt. Der Scanner ließt “Q820”. So kann man über intelligente Software-Mechanismen die Füllmenge automatisch in der Software an der richtigen Stelle eintragen und buchen (das “Q” wird dann automatisch entfernt). Im Feld (8) Sachnummer wird teilweise eine Zusammenfassung der einzelnen Daten zusätzlich im rechten Bereich des Feldes in einem 2-dimensionalen Code PDF417 gedruckt. Dann ist mit einer einzigen Barcodelesung der ganze Datensatz erfassbar. Die umfassende Spezifikation des VDA-Warenanhängers finden Sie direkt beim VDA. Weitere Schriftfonts zur Erstellung des Strichcodes Code 39 in anderen Größen und Modulbreiten finden Sie hier |
VDA- und KLT-Tool
Automobilzulieferer und -konzerne haben für Versand und Wareneingang ein normiertes Etikett mit den wichtigsten Daten
definiert.
Dieses Etikett beinhaltet die Informationen in Klarschrift und auch als Barcode für eine schnelle und fehlerfreie
Identifikation mit Barcodescannern.
Die AIDC-Box bietet eine kostengünstige Variante, um diese sogenannten VDA*- (VDA 4902 Ver. 4) und KLT-Etiketten
inkl. Barcode mit herkömmlichen Laserdruckern auf DIN A4-Papier oder auf Klebeetiketten auszudrucken.
Voraussetzungen:
- Windows XP / Vista / Win 7 / Win8 / Win 8.1
- MS-Excel 2003, 2007, 2010, 2013 (2010 / 13 auch als 64 Bit)
- empfohlen: Laserdrucker
Highlights:
Installieren Sie innerhalb weniger Minuten die Software, geben die Daten in die bestehende integrierte Datenbank ein und starten den Druck der fertigen Layouts.
VDA- und KLT-Etiketten können abwechselnd über die interne Excel-Datenbank ausgedruckt werden.
Sechs Sprachen (D, E, F, S, I, P) stehen für die Etikettenbeschriftung zur Auswahl.
Such- und Markierfunktion von Datensätzen in der Datenbank.
Verschiedene Druckmodi wie Einzeldruck, Einzeldruck fortlaufend, Seriendruck, partieller Druck von Datenbankbereichen sowie Ausdruck markierter Datensätze sind wählbar.
Als separate Lizenz mit englischer Benutzeroberflche erhältlich.
- Gedruckte Etikettendaten werden in einer externen Tabelle (zur Protokollierung mit Systemzeitstempel) aufgezeichnet. Die Tabelle ist geschützt gegen Veränderungen durch die Nutzer.

VDA-Etikett für Paletten und Gitterboxen

KLT-Etikett für Kleinladungsträger
Download kostenlose Testversion und Download Kurzeinweisung.
In der Testversion sind einige Felder mit fixem Text hinterlegt weitere Einschränkungen sind nicht enthalten.
*VDA = Verband der Automobilindustrie / MS Windows XP, VISTA, WIN7, WIN8, WIN8.1, MS Excel sind eingetragene Warenzeichen de
WARUM UDI?
Vom Hersteller bis zum Anwender medizinischer Produkte, bringt UDI an allen Stellen der Versorgungskette Vorteile mit sich (detaillierte Informationen unter "Vorteile von UDI") : Hersteller nutzen den eindeutigen Code für die fehlerfreie und blitzschnelle Erfassung im Fertigungsprozess, im Lager, in der Kommissionierung und beim Versand.
In der Logistik ist der eindeutige Barcode millionenfach bewährt. UDI ermöglicht die Erfassung von Standorten, Transporten und Vorgehensweisen bei Prozessen (z. B. dem Sterilisationsprozess).
Damit werden manuelle Eingaben vermieden, Verfahren automatisiert und fehlerfrei dokumentiert. Empfängern dient der Code beim Wareneingang, im Zwischenlager und schließlich bei der Zubuchung tatsächlicher Verbräuche.
Letztendlich erhöht UDI die Patientensicherheit, denn der Weg der medizinischen Produkte ist zu jedem Zeitpunkt eindeutig rückverfolgter.
WANN? UDI JETZT !
Die verbindliche Einführung der UDI-Kennzeichnung erfolgt phasenweise von 2014 bis 2020 in Abhängigkeit der Risikofaktoren des jeweiligen Produkts. Vom entsprechenden Stichtag an dürfen Medizinprodukte nur noch mit der UDI-Codierung ausgeliefert werden.
Geräte der Klasse III müssen bis September 2014 der Richtlinie entsprechen. Bis September 2015 müssen lebenserhaltende oder lebensunterstützende Implantate mit der UDI Richtlinie in Übereinstimmung gebracht werden.
Medizingeräte der Klasse II haben bis September 2016 der Richtlinie ebenso zu entsprechen, wie Geräte der Klasse I bis September 2018.

* Klasse II und I Implantate; lebensrettende und lebenserhaltende medizinische Produkte
 UDI Kennzeichnung auf dem Produkt
UDI Kennzeichnung auf dem Produkt  UDI Kennzeichnung auf dem Produkt
UDI Kennzeichnung auf dem Produkt
WO wird UDI eingeführt?
Neben den aktuellen UDI-Anforderungen in den USA und der Türkei, sind verbindliche Regelungen für EU und Asien in Vorbereitung.
Auf europäischer Ebene wird sich bereits für eine weltweite Kompatibilität ausgesprochen. Um auf diese Entwicklung vorbereitet zu sein, sollten Hersteller, die auch außerhalb der USA und der Türkei liefern, ab sofort UDI konforme Codes benutzen.
WIE wird UDI zur globalen Referenz?
Die zentrale Datenbank "Global Unique Device Identification Database" (GUDID) dient der Registrierung von Medizinprodukten mit zugehörigen Herstellerdaten.
Ist ein Produkt hier registriert, können alle von der Herstellung bis zur Anwendung Beteiligten, aber auch die Öffentlichkeit darauf zurückgreifen.
Mit Hilfe eines bedienerfreundlichen Zugriffs können Anwender Suchvorgänge starten oder Informationen direkt einsehen. Perspektivisch wird GUDID mit Datenbanken weltweit vernetzt sein.
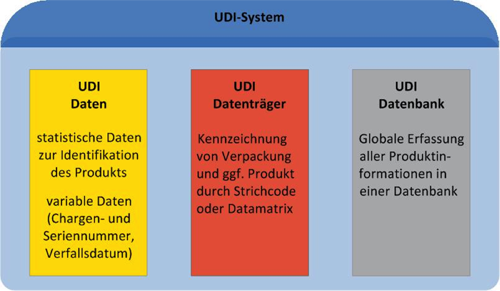
WELCHE Informationen stehen im Code?
In einem UDI-Code finden sich alle zur Rückverfolgbarkeit des Produkts benötigten Daten.
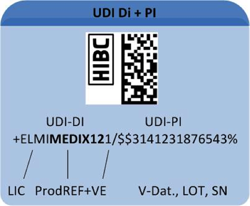
Der Code setzt sich aus zwei Komponenten zusammen (detaillierte Informationen zur Codestruktur unter "Health Care Barcode"):
1. Der „UDI-Device Identifier (UDI-DI)“ enthält die ID des Herstellers/Etikettierers,
2. den Referenzcode des Produkts und ggf. einen Code auf der Verpackung.
3. Der variable „UDI-Production Identifier (UDI-PI)“ kann das Verfallsdatum, die Angabe LOT,
4. eine Seriennummer oder auch das Herstellungsdatum enthalten.
|
Vorteile von UDI |
||||||||
Von UDI profitieren nach vollständiger Umsetzung sowohl Hersteller und Lieferanten als auch Gesundheitseinrichtungen und Patienten:
UDI wird die Basis für eine globale und sichere Distributionskette bilden, welche Abweichungen und Produktpiraterie erschwert und auf medizinische Notfälle vorbereitet. UDI nutzt dem Hersteller mit einer fehlerfreien und blitzschnellen Erfassung im Fertigungsprozess, im Lager, in der Kommissionierung und beim Versand. UDI dient dem Empfänger beim Wareneingang, im Zwischenlager und bei der Zubuchung tatsächlicher Verbräuche. UDI erleichtert die Logistik und erfasst Standorte, Bewegungen, Transporte und Vorgehensweisen beim Transport. UDI ermöglicht ein exakteres Dokumentations- und Berichtswesen. Fehlleistungen können somit kurzfristig analysiert und zugeordnet werden. UDI eröffnet medizinischen Fachkräften die Möglichkeit, einzelne Geräte schnell und eindeutig zu identifizieren, Informationen hinsichtlich ihrer Spezifikation aufzurufen und dadurch medizinische Fehler zu vermeiden. UDI stellt eine standardisierte Produktkennung zur Verfügung, mit deren Hilfe Hersteller, Lieferanten und Gesundheitseinrichtungen Geräterückrufe besser handhaben können. UDI ebnet den Weg in Richtung einer global anerkannten Identifizierungsmethode für Medizintechnik. UDI schafft einen allgemein gültigen Standard, der die technische Auswertung am Markt befindlicher Medizintechnik fördert. Dank UDI können diese Auswertungen auch in der klinischen Datenverarbeitung, in elektronischen Patientenakten und in Datenbanken verarbeitet werden. Eine umfassen-dere Marktbeobachtung kann Hinweise auf die Notwendigkeit zur Weiterentwicklung am Markt befindlicher Medizintechnik und ihrer Verkaufszahlen liefern und lässt Rückschlüsse auf neue Einsatzmöglichkeiten bekannte Technologien zu.
|
||||||||